HU-210 - синтетический каннабиноид, который был впервые синтезирован в 1988 году из (1R,5S)-миртенола группой под руководством Рафаэля Мечулама в Еврейском университете. HU-210 в 100-800 раз мощнее, чем натуральный ТГК из конопли, и обладает увеличенной продолжительностью действия. HU-210 имеет сродство связывания 0,061 нМ к CB1 и 0,52 нМ к CB2 в клонированных каннабиноидных рецепторах человека. По сравнению с дельта-9-ТГК 40,7 нМ на CB1. HU-210 является (-)-1,1-диметилгептильным аналогом 11-гидрокси- Δ8-тетрагидроканнабинола; в некоторых источниках он называется 1,1-диметилгептилом 11-гидрокситетрагидроканнабинола. Аббревиатура "HU" означает Еврейский университет.
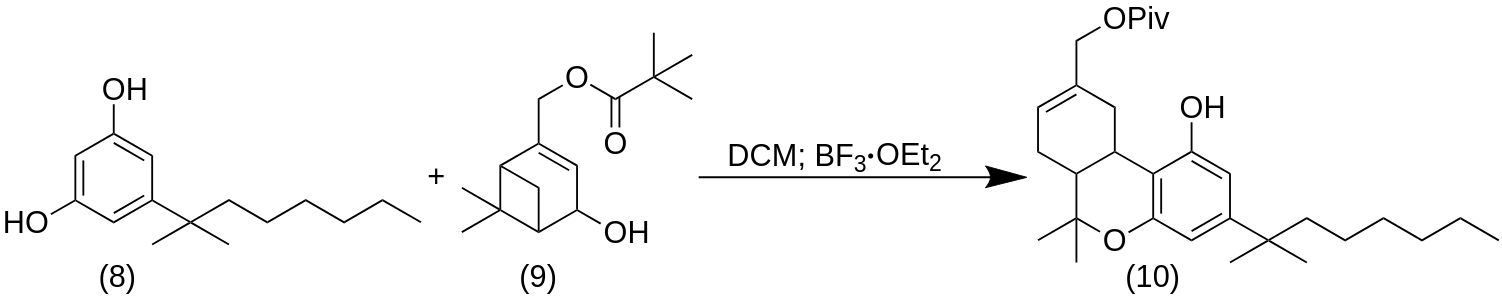
Резорцинол (8) был идентифицирован как ключевой промежуточный продукт, который вступает в реакцию с обоими энантиомерами 4-гидрокси-миртенил пивалата (9), образуя желаемые структурные каркасы, подобные ТГК. Синтез ключевого фторированного строительного блока (8) оказался сложной задачей. Фактически, для получения (8) был использован ряд неудачных подходов. Синтез 8 начался с метилирования коммерчески доступного (3,5-диметоксифенил)ацетонитрила (1), что позволило получить α,α-диметилнитрил (2) с отличным выходом. Последующее гидридное восстановление (2) позволило получить альдегид (2), который был подвергнут олефинированию по Виттигу с выходом соли фосфония (5), что позволило получить ненасыщенное вещество (6) в виде единственного изомера, предположительно имеющего (Z)-геометрию. Связь CvC в (6) была затем гидрирована (Pd/C, H 2 , в EtOAc) с получением соединения (7) с количественным выходом. Обработка (7) с MeMgI при 170 °C дала деметилированный спирт (8) с очень хорошим выходом. Синтез (-)-(R, R)-HU-210 был осуществлен из коммерчески доступного (-)-(1R)-миртенола (≥95% ee), который был превращен в 4-гидроксимиртенил пивалат (9) по методу Захалки и Хумана. Наконец, восстановление с помощью LiAlH4 дало целевое соединение (-)-(R, R)-HU-210. Поскольку источником хиральности в синтезе являются два энантиомера 4-гидроксимиртенилпивалата (9), ee двух конечных соединений отражает ee коммерчески доступных исходных материалов. Энантиомерная чистота каннабиноидных мимиков была подтверждена аналитической хиральной ВЭЖХ. Впоследствии (-)-(R, R)-HU-210 были очищены с помощью полупрепаративной хиральной ВЭЖХ для получения высокочистых (>99% ee) отдельных энантиомеров для фармакологических анализов.
Оборудование и стеклянная посуда:
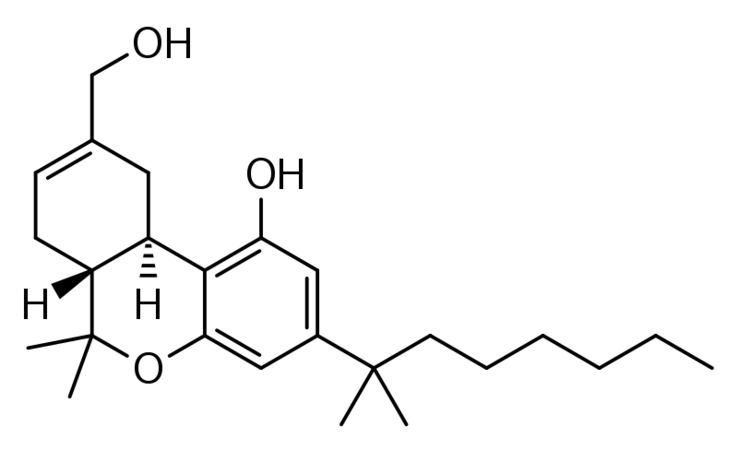
(6aR,10aR)-3-(1,1-Диметилгептил)-6a,7,10,10a-тетрагидро-1-гидрокси-6,6-диметил-6H-дибензо[b,d]пиран-9-метанол:
Температура кипения: 485,51 при 760 мм рт. ст;
Температура плавления: 205,83 °C;
Молекулярная масса: 386,576 г/моль;
Плотность: 1,0±0,1 г/мл;
CAS номер: 112830-95-2.
Синтез прекурсоров
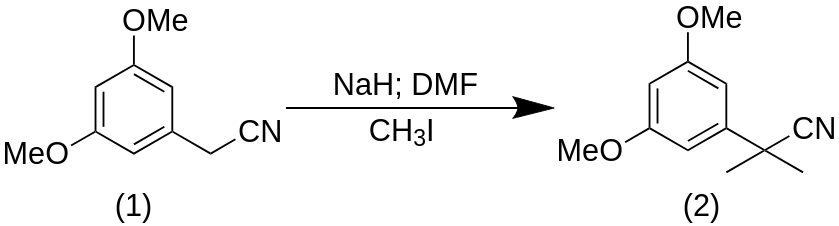
2-(3,5-Диметоксифенил)-2-метилпропаненитрил (2)
К перемешиваемой суспензии гидрида натрия (60% в минеральном масле, 677 мг, 16,9 ммоль, 3 экв.) в сухом ДМФ (5.0 мл) при 0 °C по каплям добавляли раствор коммерчески доступного 2-(3,5-диметоксифенил)ацетонитрила (1) (1,0 г, 5,64 ммоль, 1 экв.) и йодометана (1,1 мл, 16,9 ммоль, 3 экв.) в сухом DMF (5,0 мл). Температура реакции повышалась до 25 °C в течение 15 минут, и перемешивание продолжалось в течение 2 ч в круглодонной колбе объемом 100 мл. Реакционную смесь гасили насыщенным водным раствором NH4Cl (5,0 мл) и разбавляли диэтиловым эфиром (10 мл). Органический слой отделяли, а водный слой экстрагировали диэтиловым эфиром (3×10 мл). Объединенный органический слой промывали водой и рассолом, сушили над Na2SO4 и выпаривали растворитель при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 8:2) с получением соединения (2) (1,1 г, 98%) в виде бесцветного масла.
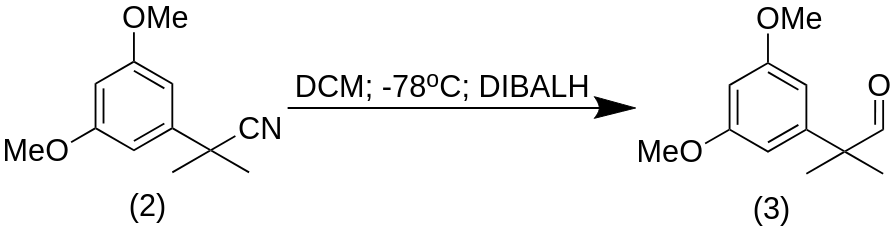
2-(3,5-Диметоксифенил)-2-метилпропаналь (3)
К раствору (2) (1,21 г, 5,90 ммоль, 1 экв.) в сухом DCM (50,0 мл) при -78 °C (в бане Дьюара с сухим льдом) добавили DIBALH (1 М раствор в гексане, 14,75 мл, 14,75 ммоль, 2,5 экв.) (C₈H₁₉Al) в 250 мл круглодонной колбе. Реакционную смесь перемешивали при той же температуре в течение 1 ч и затем гасили капельным добавлением тартрата калия-натрия (10% раствор в воде, 20 мл). Полученную смесь нагревали до комнатной температуры, энергично перемешивали в течение 1 ч, а затем разбавляли EtOAc (20 мл). Органическую фазу отделили, а водную фазу экстрагировали EtOAc (3×50 мл). Объединенный органический слой промыли водой и рассолом, высушили над Na2SO4 и выпарили растворитель при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 8:2) с получением альдегида (3) (1,14 г, 93%) в виде бесцветного масла.
5-(Бромтрифенил-λ5-фосфанил)пентан (5)
К раствору коммерчески доступного 5-бромпентана (4) (3,134 мл, 16,6 ммоль, 1 экв.) в EtOH (35 мл) добавили трифенилфосфин (4,35 г, 16,6 ммоль, 1 экв.) и K2CO3 (2,30 г, 16,6 ммоль, 1 экв.) и смесь нагревали при рефлюксе в течение ночи в 250 мл круглодонной колбе. Растворитель выпарили при пониженном давлении, неочищенный продукт растворили в толуоле (35 мл) и смесь энергично перемешивали при 100 °C в течение 5 мин. Смесь охлаждали до комнатной температуры и кристаллизованную соль фосфония (5) (74%) собирали фильтрованием в виде белого кристаллического вещества.
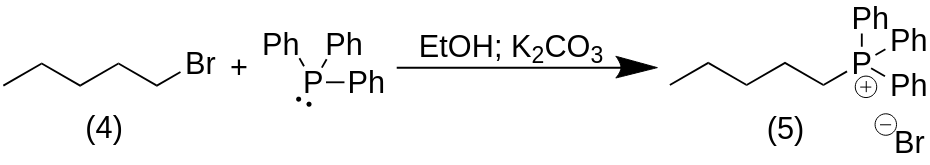
(5Z)-7-(3,5-Dimethoxyphenyl)-7-methyloct-5-en (6)
К суспензии соли фосфония (5) (27,3 ммоль, 5 экв.) в сухом THF (130 мл) при 0 °C по каплям добавляли LiHMDS (LiN[(CH₃)₃Si]₂) (1 M в THF, 27,3 мл, 27,3 ммоль, 5 экв.) в 500 мл круглодонной колбе. Смесь нагревали до 10 °C и перемешивали в течение 30 мин для обеспечения полного образования оранжевого иллида. Раствор альдегида (3) (1,1 г, 5,46 ммоль, 1 экв.) в THF (15 мл) добавляли по каплям к полученной суспензии при той же температуре. Реакцию перемешивали в течение ночи при комнатной температуре. Смесь гасили добавлением насыщенного водного NH4Cl (10 мл). Органический слой был отделен, и водная фаза была экстрагирована Et2O (3×100 мл). Объединенный органический слой промыли рассолом, высушили над Na2SO4 и выпарили растворитель при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 7:3) с получением алкена (6) (92%, один диастереоизомер) в виде бесцветного масла.
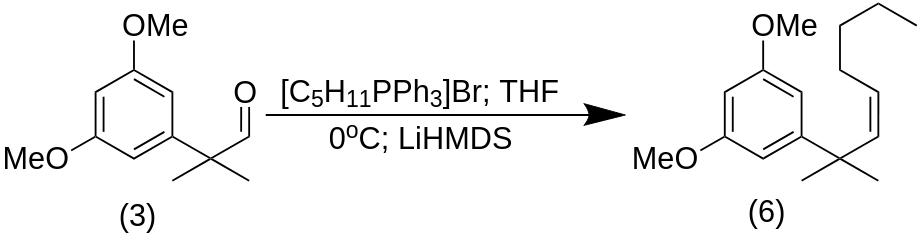
7-(3,5-Диметоксифенил)-7-метилоктан (7)
К раствору (6) (5,0 ммоль, 1 экв.) в EtOAc (200 мл) добавили 10% Pd/C (139 мг), и полученную суспензию энергично перемешивали под атмосферой водорода в течение ночи при комнатной температуре в 500 мл RBF. Катализатор был удален фильтрованием через Целит, и фильтрат был выпарен при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 6:4) с получением гидрированного соединения (7) (количественный выход) в виде бесцветного масла.
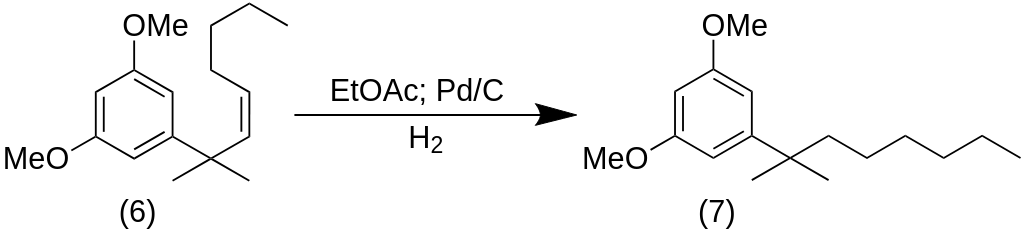
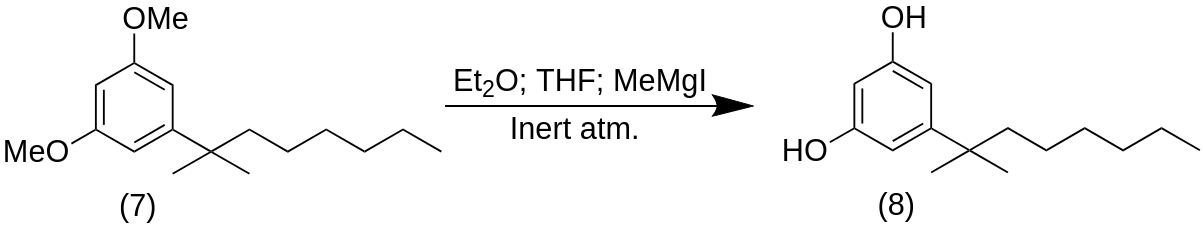
5-(2-methyloctan-2-yl)benzene-1,3-diol (8)
К раствору соединения (7) (1,20 ммоль, 1 экв.) в сухом Et2O (5,0 мл) и сухом THF (0,4 мл) добавляли MeMgI (3 M в Et2O, 8,0 мл, 24,0 ммоль, 20 экв.) при 0 °C в 100 мл RBF. Суспензию нагревали до 100 °C при пониженном давлении, затем остаток нагревали до 170 °C в течение 1 ч под потоком азота. Охлажденную реакционную смесь гасили насыщенным водным NH4Cl (10 мл) и экстрагировали EtOAc (5×20 мл). Объединенный органический слой промывали рассолом, сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Неочищенный продукт (8) был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 1:1) с получением спирта (8) (70%) в виде воскообразного белого твердого вещества.
Синтез продукта
[(6aR,10aR)-3-(2-methyloctan-2-yl)-1-hydroxy-6,6-dimethyl-6H,6aH,7H,10H,10aH-benzo[c]isochromen-9-yl]methyl 2,2-dimethylpropanoate (10)
К раствору резорцинола (8) (0,19 ммоль, 1 экв.) и пивалатного эфира (9) (48 мг, 0,19 ммоль, 1 экв.) в сухом DCM (65 мл) при -20 °C добавили BF3-OEt2 (0,12 мл, 1,0 ммоль, 5,3 экв.) в 250 мл RBF. Смеси дали нагреться до комнатной температуры и затем перемешивали в течение 2 ч. Смесь тщательно промыли рассолом, над Na2SO4, отфильтровали и растворитель выпарили при пониженном давлении. Неочищенный продукт очистили флэш-хроматографией на силикагеле (гексан/EtOAc 9:1) с получением соединения (10) (55%) в виде воскообразного белого твердого вещества.
(-)-(R,R)-HU-210 (11)
Раствор защищенного эфира (10) (0,098 ммоль, 1 экв.) в сухом THF (1,0 мл) был добавлен по каплям к суспензии LiAlH4 (15,3 мг, 0,39 ммоль, 4 экв.) в THF (1,0 мл) при 0 °C в 50 мл грушевидной колбе. Реакционную смесь перемешивали в течение 2 ч и дали ей нагреться до комнатной температуры. Реакцию гасили водой (2 мл) и экстрагировали эфиром (2×5 мл). Объединенный органический слой промыли рассолом, высушили над Na2SO4 и выпарили растворитель при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 8:2) с получением конечного соединения (-)-(R, R)-HU-210 (11) (50%, ee 97%) в виде гигроскопичного белого твердого вещества. Конечный продукт был впоследствии очищен с помощью хиральной ВЭЖХ (подробности см. в Экспериментальной части) с целью получения (-)-(R, R)-HU-210 энантиомерно чистого (ee 100%).
Резорцинол (8) был идентифицирован как ключевой промежуточный продукт, который вступает в реакцию с обоими энантиомерами 4-гидрокси-миртенил пивалата (9), образуя желаемые структурные каркасы, подобные ТГК. Синтез ключевого фторированного строительного блока (8) оказался сложной задачей. Фактически, для получения (8) был использован ряд неудачных подходов. Синтез 8 начался с метилирования коммерчески доступного (3,5-диметоксифенил)ацетонитрила (1), что позволило получить α,α-диметилнитрил (2) с отличным выходом. Последующее гидридное восстановление (2) позволило получить альдегид (2), который был подвергнут олефинированию по Виттигу с выходом соли фосфония (5), что позволило получить ненасыщенное вещество (6) в виде единственного изомера, предположительно имеющего (Z)-геометрию. Связь CvC в (6) была затем гидрирована (Pd/C, H 2 , в EtOAc) с получением соединения (7) с количественным выходом. Обработка (7) с MeMgI при 170 °C дала деметилированный спирт (8) с очень хорошим выходом. Синтез (-)-(R, R)-HU-210 был осуществлен из коммерчески доступного (-)-(1R)-миртенола (≥95% ee), который был превращен в 4-гидроксимиртенил пивалат (9) по методу Захалки и Хумана. Наконец, восстановление с помощью LiAlH4 дало целевое соединение (-)-(R, R)-HU-210. Поскольку источником хиральности в синтезе являются два энантиомера 4-гидроксимиртенилпивалата (9), ee двух конечных соединений отражает ee коммерчески доступных исходных материалов. Энантиомерная чистота каннабиноидных мимиков была подтверждена аналитической хиральной ВЭЖХ. Впоследствии (-)-(R, R)-HU-210 были очищены с помощью полупрепаративной хиральной ВЭЖХ для получения высокочистых (>99% ee) отдельных энантиомеров для фармакологических анализов.
Оборудование и стеклянная посуда:
- Круглодонные колбы на 100 мл, 250 мл, 500 мл (RBF);
50 мл грушевидная колба;
Штатив для реторты и зажимы для крепления приборов;
Магнитная мешалка с нагревателем;
100 мл x3; 50 мл x2 Мензурка;
500 мл Сепарационная воронка;
Капельная воронка на 100 мл;
Баня Дьюара;
водяная баня;
Твердый CO2 (сухой лед);
Источник вакуума;
Стеклянная палочка и шпатель;
Ротовап машина;
Пластиковый или стеклянный шприц;
Колба Эрленмейера 150-200 мл x2;
Рефлюкс-конденсатор;
Набор для флэш-хроматографии;
Колба Бюхнера и воронка [для небольших количеств можно использовать фильтр Шотта];
Лабораторный термометр (от -50 °C до 200 °C) с адаптером для колбы;
Баллон с азотом (N2) или аргоном (Ar) объемом ~10 л (1 атм);
Источник газообразного водорода (H2);
Лабораторные весы (подходят 0,001-100 г) [зависит от загрузки синтеза].
- Гидрид натрия (NaH) 60% в минеральном масле, 677 мг, 16,9 ммоль;
Диметилформамид (DMF) 10,0 мл;
2-(3,5-диметоксифенил)ацетонитрил (1) 1,0 г, 5,64 ммоль;
йодометан (CH3I) 1,1 мл, 16,9 ммоль;
Водный раствор хлорида аммония (NH4Cl) (25,0 мл);
Диэтиловый эфир (Et2O) 363 мл;
Сульфат натрия (Na2SO4) или сульфат магния (MgSO4) ~150 г;
Дихлорметан (DCM) 115,0 мл;
DIBALH (C₈H₁₉Al) 1 M раствор в гексане, 14,75 мл, 14,75 ммоль;
Тартрат натрия 10% раствор в воде, 20 мл;
Этилацетат (EtOAc) 1070 мл;
Дистиллированная вода ~1 л;
Хлорид натрия (NaCl) ~100 г;
Гексан ~650 мл;
5-бромпентан (4) 3,134 мл, 16,6 ммоль;
Этанол (EtOH) 35 мл;
Трифенилфосфин (Ph3P) 4,35 г, 16,6 ммоль;
Карбонат калия (K2CO3) 2,30 г, 16,6 ммоль;
Толуол 35 мл;
Тетрагидрофуран (THF) 179 мл;
Pd/C 10% 139 мг;
Йодид метилмагния (MeMgI) 3 М в Et2O, 8,0 мл, 24,0 ммоль;
Пивалатный эфир (9) 48 мг, 0,19 ммоль;
Эфират трифторида бора (BF3-OEt2) 0,12 мл, 1,0 ммоль;
Гидрид алюминия лития (LiAlH4) 15,3 мг, 0,39 ммоль.

(6aR,10aR)-3-(1,1-Диметилгептил)-6a,7,10,10a-тетрагидро-1-гидрокси-6,6-диметил-6H-дибензо[b,d]пиран-9-метанол:
Температура кипения: 485,51 при 760 мм рт. ст;
Температура плавления: 205,83 °C;
Молекулярная масса: 386,576 г/моль;
Плотность: 1,0±0,1 г/мл;
CAS номер: 112830-95-2.
Синтез прекурсоров
2-(3,5-Диметоксифенил)-2-метилпропаненитрил (2)
К перемешиваемой суспензии гидрида натрия (60% в минеральном масле, 677 мг, 16,9 ммоль, 3 экв.) в сухом ДМФ (5.0 мл) при 0 °C по каплям добавляли раствор коммерчески доступного 2-(3,5-диметоксифенил)ацетонитрила (1) (1,0 г, 5,64 ммоль, 1 экв.) и йодометана (1,1 мл, 16,9 ммоль, 3 экв.) в сухом DMF (5,0 мл). Температура реакции повышалась до 25 °C в течение 15 минут, и перемешивание продолжалось в течение 2 ч в круглодонной колбе объемом 100 мл. Реакционную смесь гасили насыщенным водным раствором NH4Cl (5,0 мл) и разбавляли диэтиловым эфиром (10 мл). Органический слой отделяли, а водный слой экстрагировали диэтиловым эфиром (3×10 мл). Объединенный органический слой промывали водой и рассолом, сушили над Na2SO4 и выпаривали растворитель при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 8:2) с получением соединения (2) (1,1 г, 98%) в виде бесцветного масла.

2-(3,5-Диметоксифенил)-2-метилпропаналь (3)
К раствору (2) (1,21 г, 5,90 ммоль, 1 экв.) в сухом DCM (50,0 мл) при -78 °C (в бане Дьюара с сухим льдом) добавили DIBALH (1 М раствор в гексане, 14,75 мл, 14,75 ммоль, 2,5 экв.) (C₈H₁₉Al) в 250 мл круглодонной колбе. Реакционную смесь перемешивали при той же температуре в течение 1 ч и затем гасили капельным добавлением тартрата калия-натрия (10% раствор в воде, 20 мл). Полученную смесь нагревали до комнатной температуры, энергично перемешивали в течение 1 ч, а затем разбавляли EtOAc (20 мл). Органическую фазу отделили, а водную фазу экстрагировали EtOAc (3×50 мл). Объединенный органический слой промыли водой и рассолом, высушили над Na2SO4 и выпарили растворитель при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 8:2) с получением альдегида (3) (1,14 г, 93%) в виде бесцветного масла.

5-(Бромтрифенил-λ5-фосфанил)пентан (5)
К раствору коммерчески доступного 5-бромпентана (4) (3,134 мл, 16,6 ммоль, 1 экв.) в EtOH (35 мл) добавили трифенилфосфин (4,35 г, 16,6 ммоль, 1 экв.) и K2CO3 (2,30 г, 16,6 ммоль, 1 экв.) и смесь нагревали при рефлюксе в течение ночи в 250 мл круглодонной колбе. Растворитель выпарили при пониженном давлении, неочищенный продукт растворили в толуоле (35 мл) и смесь энергично перемешивали при 100 °C в течение 5 мин. Смесь охлаждали до комнатной температуры и кристаллизованную соль фосфония (5) (74%) собирали фильтрованием в виде белого кристаллического вещества.
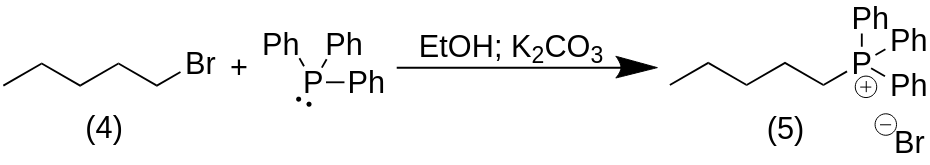
(5Z)-7-(3,5-Dimethoxyphenyl)-7-methyloct-5-en (6)
К суспензии соли фосфония (5) (27,3 ммоль, 5 экв.) в сухом THF (130 мл) при 0 °C по каплям добавляли LiHMDS (LiN[(CH₃)₃Si]₂) (1 M в THF, 27,3 мл, 27,3 ммоль, 5 экв.) в 500 мл круглодонной колбе. Смесь нагревали до 10 °C и перемешивали в течение 30 мин для обеспечения полного образования оранжевого иллида. Раствор альдегида (3) (1,1 г, 5,46 ммоль, 1 экв.) в THF (15 мл) добавляли по каплям к полученной суспензии при той же температуре. Реакцию перемешивали в течение ночи при комнатной температуре. Смесь гасили добавлением насыщенного водного NH4Cl (10 мл). Органический слой был отделен, и водная фаза была экстрагирована Et2O (3×100 мл). Объединенный органический слой промыли рассолом, высушили над Na2SO4 и выпарили растворитель при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 7:3) с получением алкена (6) (92%, один диастереоизомер) в виде бесцветного масла.

7-(3,5-Диметоксифенил)-7-метилоктан (7)
К раствору (6) (5,0 ммоль, 1 экв.) в EtOAc (200 мл) добавили 10% Pd/C (139 мг), и полученную суспензию энергично перемешивали под атмосферой водорода в течение ночи при комнатной температуре в 500 мл RBF. Катализатор был удален фильтрованием через Целит, и фильтрат был выпарен при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 6:4) с получением гидрированного соединения (7) (количественный выход) в виде бесцветного масла.

5-(2-methyloctan-2-yl)benzene-1,3-diol (8)
К раствору соединения (7) (1,20 ммоль, 1 экв.) в сухом Et2O (5,0 мл) и сухом THF (0,4 мл) добавляли MeMgI (3 M в Et2O, 8,0 мл, 24,0 ммоль, 20 экв.) при 0 °C в 100 мл RBF. Суспензию нагревали до 100 °C при пониженном давлении, затем остаток нагревали до 170 °C в течение 1 ч под потоком азота. Охлажденную реакционную смесь гасили насыщенным водным NH4Cl (10 мл) и экстрагировали EtOAc (5×20 мл). Объединенный органический слой промывали рассолом, сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Неочищенный продукт (8) был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 1:1) с получением спирта (8) (70%) в виде воскообразного белого твердого вещества.

Синтез продукта
[(6aR,10aR)-3-(2-methyloctan-2-yl)-1-hydroxy-6,6-dimethyl-6H,6aH,7H,10H,10aH-benzo[c]isochromen-9-yl]methyl 2,2-dimethylpropanoate (10)
К раствору резорцинола (8) (0,19 ммоль, 1 экв.) и пивалатного эфира (9) (48 мг, 0,19 ммоль, 1 экв.) в сухом DCM (65 мл) при -20 °C добавили BF3-OEt2 (0,12 мл, 1,0 ммоль, 5,3 экв.) в 250 мл RBF. Смеси дали нагреться до комнатной температуры и затем перемешивали в течение 2 ч. Смесь тщательно промыли рассолом, над Na2SO4, отфильтровали и растворитель выпарили при пониженном давлении. Неочищенный продукт очистили флэш-хроматографией на силикагеле (гексан/EtOAc 9:1) с получением соединения (10) (55%) в виде воскообразного белого твердого вещества.

(-)-(R,R)-HU-210 (11)
Раствор защищенного эфира (10) (0,098 ммоль, 1 экв.) в сухом THF (1,0 мл) был добавлен по каплям к суспензии LiAlH4 (15,3 мг, 0,39 ммоль, 4 экв.) в THF (1,0 мл) при 0 °C в 50 мл грушевидной колбе. Реакционную смесь перемешивали в течение 2 ч и дали ей нагреться до комнатной температуры. Реакцию гасили водой (2 мл) и экстрагировали эфиром (2×5 мл). Объединенный органический слой промыли рассолом, высушили над Na2SO4 и выпарили растворитель при пониженном давлении. Неочищенный продукт был очищен флэш-хроматографией на силикагеле (гексан/EtOAc 8:2) с получением конечного соединения (-)-(R, R)-HU-210 (11) (50%, ee 97%) в виде гигроскопичного белого твердого вещества. Конечный продукт был впоследствии очищен с помощью хиральной ВЭЖХ (подробности см. в Экспериментальной части) с целью получения (-)-(R, R)-HU-210 энантиомерно чистого (ee 100%).
More Thread Same Category
- Способы курения гашиша для ньюфагов
- Рецепт твердой основы для синтетического гашиша
- Синтез JWH-018 с помощью реактива Гриньяра
- Готовые рецепты на ТВ, Россыпь и Мягкий
- Марихуанна - Marijuana
- Готовим канна-масло дома
- Секреты приготовления синтетического гашиша: проверенный рецепт
- Синтез CP-47,497 - синтетический гашиш
- Синтез ТГК - Тетрагидроканнабинол - обзор
- Синтез QUPIC (PB-22) синтетический гашиш
- Изомеризация каннабидиола (CBD) в психоактивные каннабиноиды
- Как приготовить качественный Микс (Спайс, Куреха, Дудка, Россыпь) от А до Я
- Синтез ТГК-О-ацетата из ТГК
- ADBICA также известный как ADB-PICA дизайнерский наркотик
- Секреты извлечения качественного гашиша: экстракция холодной водой и прессовка пудры